Science

A smarter way to
deliver mRNA
Navibody mRNA therapeutics delivery platform
항체-LNP 치료제의 타겟 특이성을 향상시키고 생산 효율성을 높인 mRNA 치료제 표적 전달 플랫폼
Why targeted Delivery matters
2020년 코로나 팬데믹을 기점으로 mRNA 기술은 전 세계 백신 시장을 혁신했습니다.
이제 그 가능성은 감염병을 넘어 유전질환, 종양학, 맞춤형 치료제까지 확장되고 있습니다.
하지만 mRNA가 표적 세포에 정확히 도달하��지 않는다면 그 잠재력은 절반밖에 발휘되지 않습니다.
정밀 타겟 딜리버리는 mRNA 치료제의 차세대 돌파구입니다.

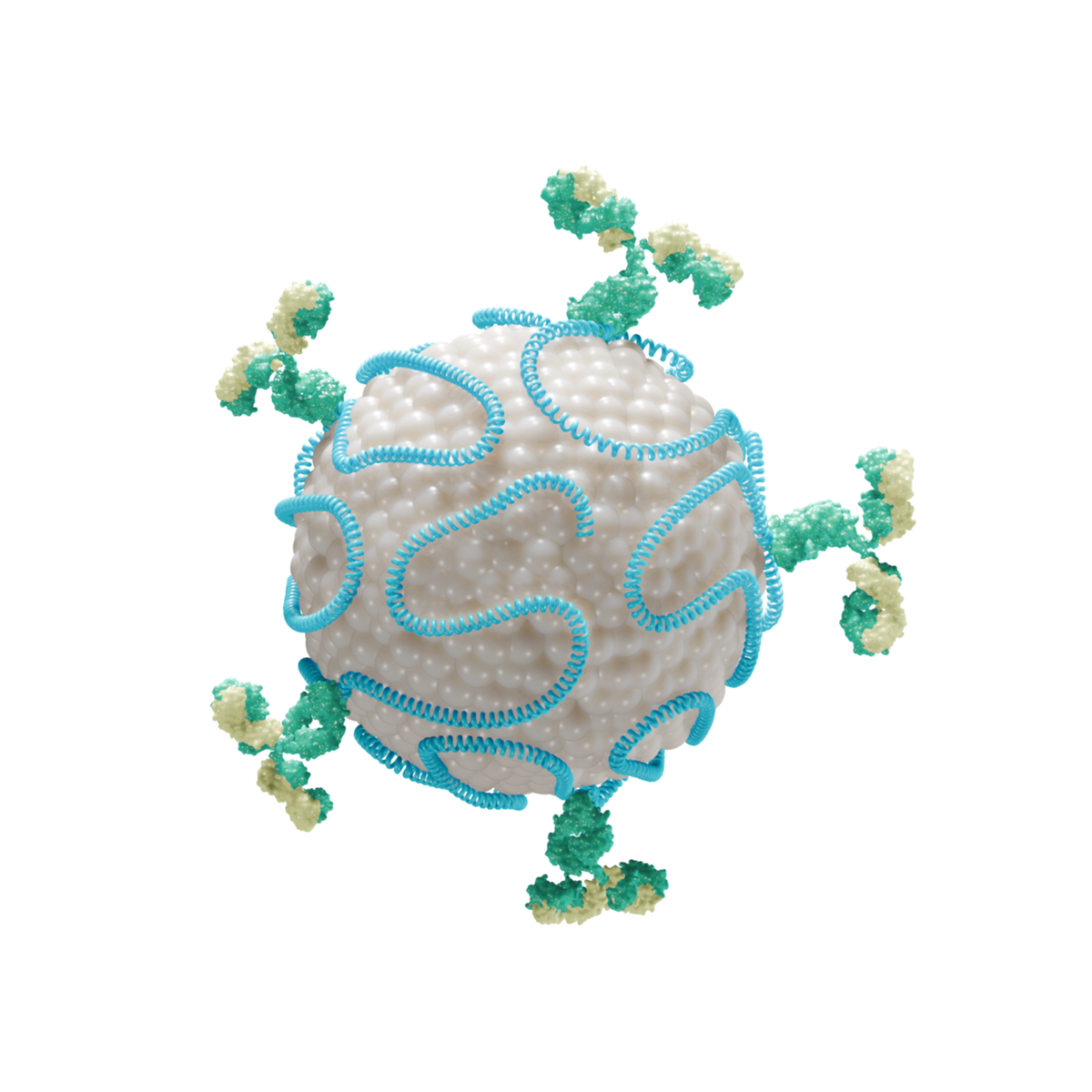

Why it works better
mRNA-LNP의 표적능 향상
mRNA-LNP 치료제의 표적능을 획기적으로 증대시켜 in-vivo 투여를 가능하게 합니다.
off-target 부작용 최소화
간, spleen 등에 잘못 전달되는 off-target 문제점을 최소화합니다.
다목적의 표적 전달 플랫폼
Navibody 기술은 다양한 항체, mRNA의 조합으로 광범위한 활용이 가능합니다.
Navibody Platform
Navibody(Navigation Antibody)는 LNP 부착 단백질과 antibody(항체)가 결합된 형태로, mRNA-LNP(mRNA 치료제가 봉입된 LNP)에 안정적으로 부착되어 이를 표적한 장기의 세포 수준까지 정확히 도달시킬 수 있는 특성을 가지고 있습니다.
mRNA(messenger RNA)
DNA에 담긴 유전 정보를 단백질을 합성하는 세포 내의 리보솜으로 전달하는 역할을 하는 RNA 분자입니다. mRNA는 이 정보를 설계도처럼 운반하여 세포가 특정 단백질을 만들 수 있도록 지시하는, 유전 정보 전달의 필수적인 매개체입니다.
LNP(Lipid Nanoparticle)
mRNA 백신이나 치료제를 세포 안으로 안전하고 효율적으로 전달하는 운반체(carrier) 역할을 하는 기술입니다. 불안정한 mRNA를 분해되지 않도록 보호하고 세포 안으로 들어갈 수 있도록 돕는 보호막과 같은 역할을 하며, 인체 내에서 임무를 마치면 소멸하는 특성이 있습니다.
Navibody의 구조
Navibody가 부착된 mRNA-LNP 치료제
Efforts of improving mRNA delivery
LNP(지질 나노입자) 치료제는 간으로 대부분 전달되던 초기 단계에서 벗어나, 이제는 다양한 장기와 특정 세포까지 정확히 도달하는 정밀 전달 기술로 발전했습니다. 엠브릭스는 세포 수준의 정밀 전달을 안전하게 구현합니다.
mRNA 표적 전달 개발의 역사
최초의 mRNA-LNP 치료제
LNP는 개발이 빠르고 안전하여 백신 등의 대체재로 각광받고 있으나 전신 투여할 경우 간에서 대부분 흡수되어 목적 효능이 나오지 않거나 부작용 가능성이 있어 치료제 개발에 문제가 한계가 있습니다.
화학적 조립 공정 vs. 원스텝 자가조립
화학 결합 방식

원스텝 자가조립

Platform expansion
내비바디 플랫폼을 사용하여 높은 활용성과 안정성, 생산성을 기반으로 여러 분야의 치료제 개발에 적용 가능합니다.
Navibody 플랫폼의 적용 가능 분야
Pipeline MGB-p53
mRNA targeted Cancer delivery
암세포를 억제하는 mRNA를 암세포에 직접 전달하여 치료의 효율을 높이고 off-target으로 인한 부작용을 줄입니다.
암 백신
면역 세포 활성화에 의한 암세포 공격으로 암 예방 및 치료제 분야에 적용 가능합니다.
방사능 암치료
방사선 치료 효능을 향상시킬 수 있습니다.
화학요법 및 면역치료
종양 미세환경이 화학요법 및 면역치료에 적합하도록 유도할 수 있습니다.
MGB-P53 작용 원리
건강한 세포
HER2가 과발현된 암세포
POC : MGB-P53
엠브릭스는 Navibody 플랫폼의 후보물질로 항체에 Trastuzumab을, mRNA치료제에 P53을 각각 선정하여 MGB-P53를 완성하였습니다.
p53
종양을 억제하는 역할로, 모든 암에서 p53이 돌연변이로 발견됨. p53을 생산하는 유전자인 TP53은 현재 가장 연구가 활발한 유전자 중 하나로 1979년 첫 발견 이후 10,000건 이상 논문에서 인용됨.
상호보완적 역할을 하는 HER2 표적과 p53 유전자
p53과 HER2의 발현
p53 돌연변이는 HER2의 과발현을 유도함

암세포 표적성 검증
Navibody를 적용한 MGB-P53의 암세포 표적 능력

MGB-P53는 LNP를 3배 전달, mRNA를 7배 발현
암세포 사멸 효과 검증
MGB-P53 투여 후 종양의 부피와 무게가 모두 감소하였음을 확인했습니다.

R&D Achievements
내비바디를 주제로 어떤 IP활동을 하고 있는지 알아보세요
12,427,204
US
25. 9. 30.
지질나노입자를 형성하는 항체막구조화 단백질이결합된 항체를 포함하는항체 결합 지질나노입자
10-2698524
KR
24. 8. 20.
막구조화 단백질이 결합된 항체를 포함하는 항체 결합 지��질나노입자
10-1647178
KR
16. 8. 3.
효소 절단성 링커 또는 올리고 라이신을 포함하는 폴리에틸렌글리콜-리피드를 이용한 안정화된 플라스미드-지질 입자
출원
KR
25. 11. 12.
돌연변이 p53 mRNA의 기능을 선택적 억제하고 정상 p53 기능을 복원하기 위한 이중 핵산 담지체 및 그 용도
출원
PCT
25. 7. 1.
P53 단백질을 암호화하는 mRNA가 탑재되어 있는 HER2 결합 지질나노입자를 함유하는 약학 조성물
출원
PCT
25. 7. 1.
표적 전달능 및 안전성이 개선된 지질나노입자 약학 조성물
출원
KR
25. 6. 30.
표적 전달능 및 안전성이 개선된 지질나노입자 약학 조성물
출원
KR
25. 6. 25.
mRNA 지질나노입자 기반 in vivo CAR-T 기술을 이용한 자가면역치료제
출원
KR
25. 6. 25.
mRNA 지질나노입자 기반 in vivo CAR-T 기술을 이용한 림프구성 혈액암 치료제
출원
KR
25. 5. 11.
암과 수지암과 수지상세포에 항원을 동시 전달할 수 있는 지질나노입자 및 이를 함유하는 항암 조성물
출원
KR
25. 3. 30.
클러스테린이 융합된 항체 및 이 항체가 자기결합하여 형성된 항체결합 지질나노입자
출원
CN
24. 8. 29.
막구조화 단백질이��결합된 항체를 포함하는항체 결합 지질나노입자
출원
IN
24. 8. 26.
막구조화 단백질이결합된 항체를 포함하는항체 결합 지질나노입자
출원
EU
24. 8. 18.
막구조화 단백질이결합된 항체를 포함하는항체 결합 지질나노입자
출원
JP
24. 7. 25.
막구조화 단백질이결합된 항체를 포함하는항체 결합 지질나노입자
출원
KR
24. 7. 2.
p53 단백질을 암호화하는 mRNA가 탑재되어 있는 HER2 결합 지질나노입자를 함유하는 약학 조성물
출원
PCT
23. 1. 26.
막구조화 단백질이 결합된 항체를 포함하는 항체 결합 지질나노입자